最近NMPA又整了個大活。發布了《體外診斷試劑分類目錄》。(詳情點擊查看:影響注冊,IVD試劑分類規則有變)這也是NMPA的傳統藝能,總是在周末下班前發法規,讓大家能利用周末的時間認真學習和思考,不耽誤上班。所以,不要讓NMPA的好意付諸東流,今天我就和大家談一談,這次分類目錄變更了什么,以及,應該如何渡過這段法規更換時間。
這次分類目錄的變更,是依據《體外診斷試劑分類規則》進行的,而分類規則實際上在21年10月底就發布了,距離現在,也接近兩年半的時間。而在這段時間當中,分類目錄依舊使用《6840體外診斷試劑分類子目錄(2013版)》,這和《分類規則》有很多沖突的地方。比如,在結構上就有很大差距。《分類子目錄》結構是序號、產品類別、產品分類名稱、預期用途和管理類別五個部分組成,這和目前的醫療器械分類目錄是不一致的。而《分類目錄》的結構則是由一級序號、一級產品類別、二級序號、二級產品類別、預期用途、管理類別六個部分組成,在結構上就向醫療器械分類目錄看齊了。而在一級產品類別當中,共包含25個類別,比《分類子目錄》的產品類別,多了3個,我將兩者做了一個對比,具體可見下表。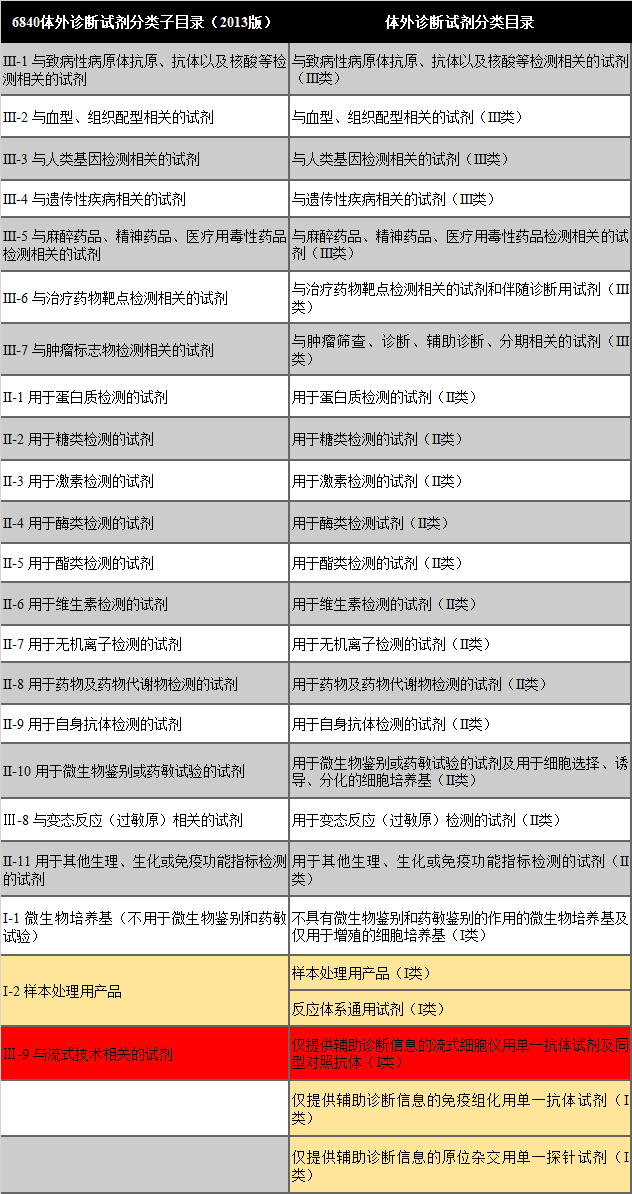
從表中我們可以看出,大部分分類的變動是很小的,變動最大的是流式技術相關的試劑,直接從三類變成一類了。但這里也留了口子,按一類管理的,是單一抗體試劑及同型對照抗體,如果要把當以抗體組合后使用的話,還是作為第二類或第三類管理。這次的《分類界定》不是簡單的調整了寫法和分類級別,對其中的預期用途也進行了修訂。 所以,對于注冊人員來說,還是需要根據自家的產品清單和分類目錄,做一下詳細的對比分析,避免遺漏帶來的巨大損失。


